Változhat-e a távolság két test között, ha azok nem mozdulnak meg? Mi történne a bioritmusunkkal, ha éveken keresztül a föld alatt élnénk? Hogy néz ki egy éppen reakcióban lévő molekula? Ez a három kérdés olyan nehéznek bizonyult a szakértők szerint, hogy megválaszolásukat a 2017-es természettudományos (fizikai, fiziológiai és orvostudományi, kémiai) Nobel-díjakkal jutalmazták. A cikksorozat első részében az utóbbi két eredményt járjunk körbe.
A mindennapok ritmusa – hogyan működik a biológiai óránk?
A 2017-es fiziológiai és orvostudományi Nobel-díjat Jeffrey C. Hall, Michael Rosbash és Michael W. Young kapta „a cirkadián ritmust szabályozó molekuláris mechanizmussal kapcsolatos felfedezéseikért.”
Nem véletlenül alakult úgy, hogy minden élőlény számára létezik egy napszak, amelyben aktív. Ha ez valahogyan felborul (vizsgaidőszak, időzónákon átívelő repülőutazás), az köztudottan közérzeti problémákhoz vezethet, illetve növeli különböző betegségek kockázatát is. Többek között ez lehet az evolúciós oka annak, hogy rendelkezünk egy „belénk ültetett” biológiai órával, ami segít észlelni a nappalt és az éjjelt, az aktív és a pihenőidőszakunkat.
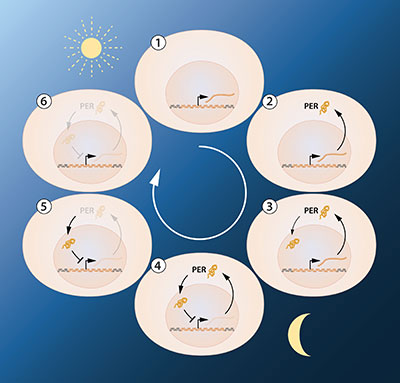
Az idei Nobel-díjasok ecetmuslicákon végzett kutatásaiból az derült ki, hogy három gén közösen szabályozza többsejtes organizmusok cirkadián ritmusát. A három génről napközben három különböző fehérje szintetizálódik. Ebből az egyik a sejtmagban felhalmozódik, és jelenlétével gátolja az őt előállító gén működését. A már kész fehérjék pedig éjszaka fokozatosan lebomlanak, így a gátlás abbamarad, reggel ismét előállítódnak a fehérjék, és a folyamat kezdődik elölről. A másik két gén, illetve a róluk megszintetizálódott fehérjék az előbbi sejtmagba való beviteléért és felhalmozódásának késleltetéséért felelnek. Utóbbira azért van szükség, mert a késleltetés nélkül egy ciklus 24 óránál hamarabb lezajlana, azaz pontosan a folyamat lényege veszne el.
A felhalmozódó fehérje gátolja a gén működését
forrás: nobelprizes.org
A fehérjék ütemszerű felhalmozódása és lebomlása nagyon sok sejt- és szervezetszintű folyamatot befolyásol közvetetten, így például a testhőmérsékletet, hormonok termelődését, a tápanyaglebontást, illetve az adott élőlény viselkedését is. Talán már ebből a felsorolásból is kitűnik, milyen alapvető jelentőségű ez a mechanizmus az élőlények megfelelő működése szempontjából. Nem véletlen, hogy a folyamat pontos feltárása és leírása Nobel-díjat ért.
Jégbe zárt atomok – hogy néz ki egy reakcióban lévő molekula?
A 2017-es kémiai Nobel-díjat Jacques Dubochet, Joachim Frank és Richard Henderson kapta a „kriogén elektronmikroszkópia kifejlesztéséért, amellyel lehetővé vált oldott biomolekulák struktúrájának nagyfelbontáson történő vizsgálata.”
Az elektronmikroszkóp megjelenése és fejlődése mindig nagy áttörésekkel kecsegtet. Hiszen segítségével olyan mérettartományok válnak láthatóvá, amelyek tulajdonságairól eddig csak számolás vagy közvetett kísérletek útján bizonyosodhatunk meg. Az elektronmikroszkóppal azonban sokáig fennállt a probléma, hogy csak már halott anyagokat lehet benne vizsgálni, hiszen a gépezetben működő elektronnyalábok elpusztítják a biomolekulákat.
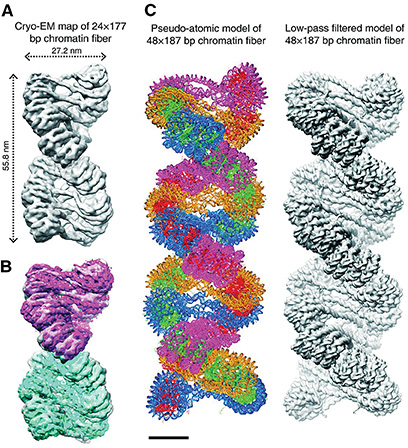
Ebbe azonban nem mindenki nyugodott bele – végül megszületett az a módszer, ami felülírja az előbbi hozzáállást. A kriogén, azaz fagyasztásos eljárás lényege, hogy a mintánkhoz vizet adunk, majd hirtelen lehűtjük. Ha lassan fagyasztanánk meg, akkor a vízmolekulák kristályokká alakulnának át, ezzel roncsolva a vizsgálni kívánt mintát. Ha a hűtés azonban pillanatok alatt játszódik le (például folyékony levegő vagy nitrogén segítségével), akkor a víznek nincs ideje kikristályosodni, és szilárdan is a folyékony állapotában lesz jelen. Ezzel pedig lényegében egy fényképet készítettünk a biomolekula egy élő állapotáról, ami roncsolás nélkül vizsgálhatóvá válik a körötte lévő vízburok miatt.
Az új eljárással készített kép a DNS-ről (A, B) és a fénykép alapján készített számítógépes modellek (C)
forrás: biomedicalcomputationreview.org
Érdekesség, hogy ezt az eljárást Dubochet már a 80-as években kifejlesztette. A dolog nehézségét tökéletesen szemlélteti, hogy a technológiát csak 2013-ra tudták optimalizálni. Ekkor sikerült a Henderson által kidolgozott és Frank révén tökéletesített 3D-s elektronmikroszkópos képalkotással megfelelő felbontású képet készíteni.
A körülbelül 30 éven keresztül tartó bajlódás azonban meghozta a gyümölcsét. 2013 óta ezzel a metódussal számtalan fehérjét, sőt a Zika-vírus felszínét is sikerült megörökíteni. Ezek a fényképek pedig új utakat nyitnak a biokémiai felfedezések jövőjében.
Hamarosan olvashatja a 2017-es fizikai Nobel-díjról szóló ismertető cikkünket is!